Passaggi di stato
Che cosa sono i passaggi di stato? E quali sono?
La materia è soggetta a trasformazioni e può quindi cambiare il proprio stato di aggregazione.
Gli stati di aggregazione sono tre:
- stato solido
- stato liquido
- stato aeriforme
Se la temperatura o la pressione variano, la materia può passare da uno stato a un altro.
Ad esempio, un cubetto di ghiaccio lasciato al sole si scioglie e diventa acqua, mentre una tisana lasciata sul fuoco inizia a bollire e diventa vapore. Tutti questi sono passaggi di stato.
Un passaggio di stato è quindi la transizione da uno stato di aggregazione a un altro al variare della temperatura o della pressione (o di entrambe).
Elenco dei passaggi di stato
I passaggi di stato sono i seguenti:
- solidificazione = da liquido a solido
- fusione = da solido a liquido
- evaporazione = da liquido ad aeriforme
- condensazione = da aeriforme a liquido
- brinamento = da aeriforme a solido
- sublimazione = da solido ad aeriforme
Ecco uno schema che può riassumere in modo chiaro tutti i passaggi di stato:
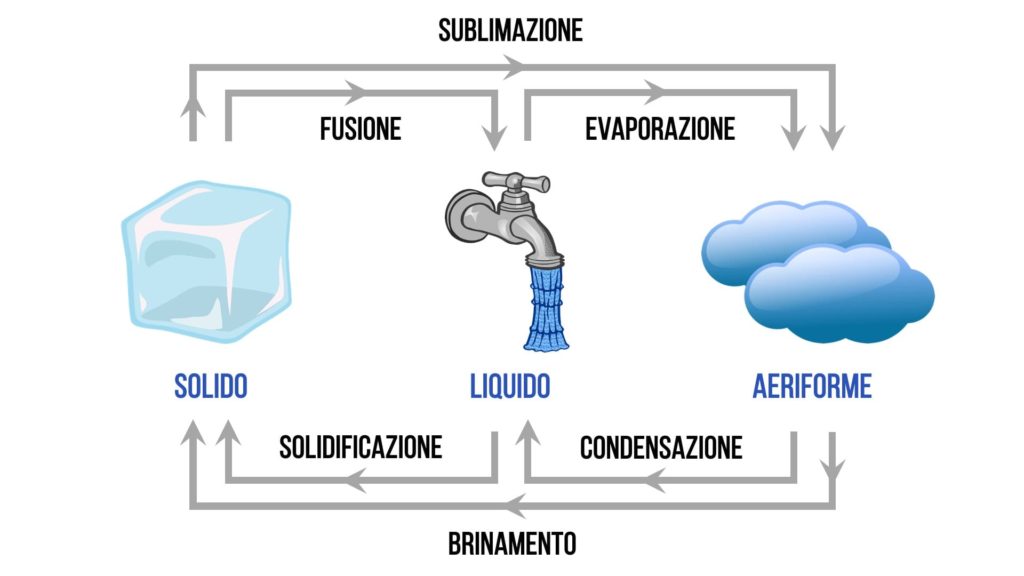
Che cosa succede durante tali passaggi? In pratica, al variare della temperatura o della pressione le particelle della materia iniziano a muoversi con maggiore o con minore libertà, avvicinandosi o allontanandosi tra loro e determinando così il passaggio da uno stato a un altro.
Ad esempio, le particelle di un cubetto di ghiaccio lasciato al sole iniziano a muoversi più liberamente, rompendo di conseguenza i legami che le tenevano unite e facendo passare il cubetto di ghiaccio dallo stato solido allo stato liquido.
Come si comportano le particelle al variare della temperatura o della pressione?
Se la temperatura aumenta, aumenta anche l’energia cinetica delle particelle, che iniziano quindi a muoversi più liberamente e a rompere in questo modo i legami che le uniscono. Viceversa, se la temperatura diminuisce, diminuisce anche l’energia cinetica delle particelle, che iniziano così ad avvicinarsi le une alle altre e a legarsi tra loro.
Se la pressione aumenta, diminuisce lo spazio in cui possono muoversi le particelle, che iniziano quindi ad avvicinarsi le une alle altre e a legarsi tra loro. Viceversa, se la pressione diminuisce, aumenta lo spazio in cui possono muoversi le particelle, che iniziano così ad allontanarsi le une dalle altre e a rompere i legami che le uniscono.
I passaggi di stato dell’acqua
Facciamo un esempio con l’acqua:
Solidificazione
Se mettiamo dell’acqua nel congelatore, l’acqua passa da liquida a solida e diventa ghiaccio.
Fusione
Se lasciamo un cubetto di ghiaccio al sole, il cubetto di ghiaccio passa da solido a liquido e diventa acqua.
Evaporazione
Se versiamo un po’ d’acqua in un pentolino e la scaldiamo, l’acqua inizia a bollire e diventa vapore.
Condensazione
Se mettiamo un coperchio sopra un pentolino pieno d’acqua che sta bollendo, il vapore si trasforma in goccioline sul coperchio e diventa liquido.
Brinamento
Nel brinamento la materia passa direttamente dallo stato aeriforme allo stato solido (senza passare per lo stato liquido).
Se d’inverno fa molto freddo e respiriamo all’aperto, il vapore si cristallizza in piccoli aghi di ghiaccio e diventa solido.
Sublimazione
Nella sublimazione la materia passa direttamente dallo stato solido allo stato aeriforme (senza passare per lo stato liquido).
Se prendiamo un pezzo di ghiaccio secco e lo lasciamo su un tavolo, si trasforma in vapore e diventa aeriforme (il ghiaccio secco si chiama così proprio perché non diventa mai liquido).
Curva di riscaldamento e diagramma di stato
Per sapere a quale temperatura si verificano i passaggi di stato di una sostanza, si usa la cosiddetta curva di riscaldamento.
Questa ad esempio è la curva di riscaldamento dell’acqua:
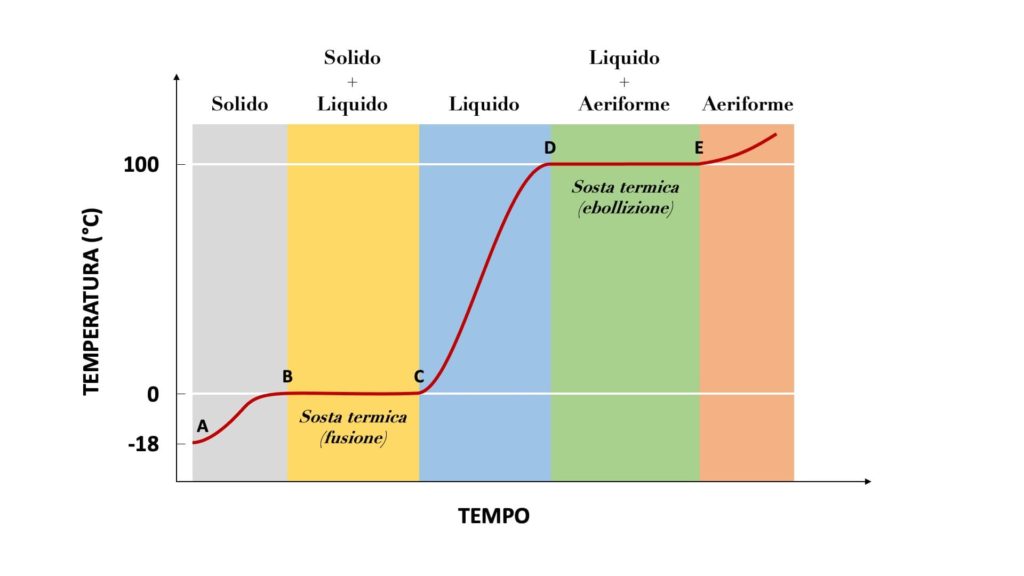
I tratti orizzontali, che prendono il nome di soste termiche, rappresentano i momenti in cui si verificano i passaggi da uno stato a un altro.
Se ad esempio prendessimo un cubetto di ghiaccio e lo lasciassimo al sole, inizierebbe a passare da solido a liquido alla temperatura di 0°.
Durante le soste termiche (cioè durante i passaggi di stato) il calore assorbito o rilasciato dalla sostanza non determina un aumento o una diminuzione della sua temperatura. In altre parole, in queste fasi la temperatura della sostanza non varia, anche se forniamo o sottraiamo calore. Questo calore prende il nome di calore latente.
Per conoscere invece le condizioni di temperatura e di pressione a cui corrispondono i vari stati di aggregazione di una sostanza, si usa il cosiddetto diagramma di stato (in altre parole, è un grafico che ci dice in quale stato si trova una sostanza a una determinata temperatura e a una determinata pressione).
