La pressione di vapore
La pressione di vapore (o tensione di vapore) è la pressione che esercita un vapore in condizioni di equilibrio con il proprio liquido.
Per capire meglio questa definizione, immaginiamo di prendere un recipiente in cui sia stato creato precedentemente il vuoto, di riempirlo per metà con un qualsiasi liquido a temperatura costante e infine di chiuderlo.
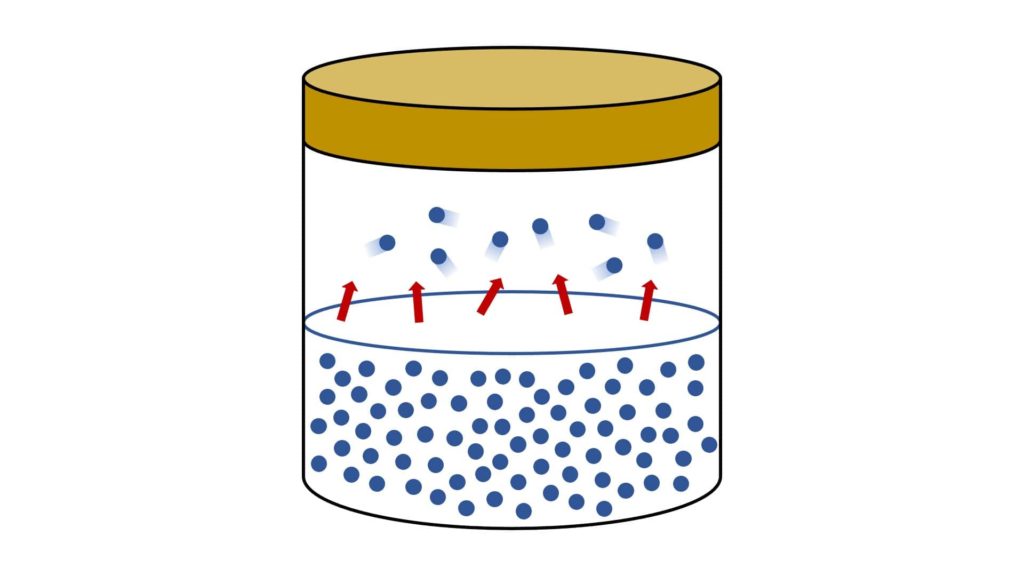
Le particelle del liquido che hanno più energia cinetica iniziano a staccarsi dalla sua superficie e a occupare la parte vuota del recipiente. In altre parole, il liquido inizia ad evaporare.
All’inizio il vapore aumenta e il liquido, anche se impercettibilmente, diminuisce, perché lo spostamento delle particelle avviene soltanto dal liquido verso il vapore (di conseguenza, inizia gradualmente a crescere anche la pressione di questo vapore):
A mano a mano però che il vapore aumenta, alcune delle sue particelle si riavvicinano alla superficie del liquido e tornano a legarsi ad esso, per cui inizia ad esserci uno scambio di particelle tra il vapore e il liquido.
In altre parole, inizia ad esserci uno spostamento di particelle sia dal liquido verso il vapore sia dal vapore verso il liquido:
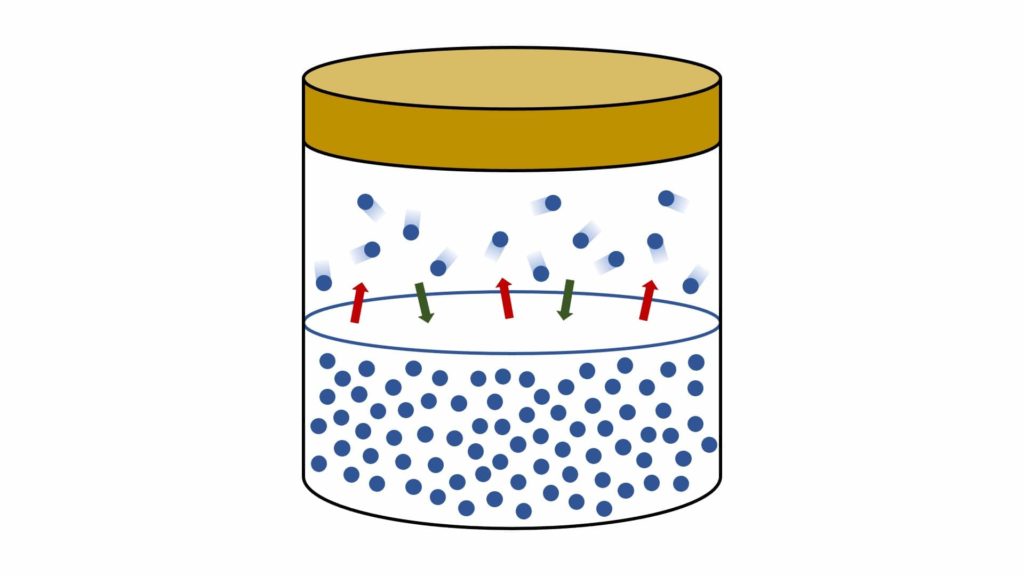
A un certo punto viene raggiunto un equilibrio dinamico, cioè una situazione in cui il numero di particelle che passano dal liquido al vapore è uguale al numero di particelle che passano dal vapore al liquido (questo equilibrio viene definito “dinamico” perché lo scambio di particelle continua a verificarsi, nonostante il numero di particelle scambiate rimanga invariato).
La pressione esercitata dal vapore in questa situazione di equilibrio prende il nome di pressione di vapore, indicata con il simbolo p°.
Pressione di vapore ed ebollizione
Qualora la temperatura del liquido aumenti, aumenta anche la pressione di vapore, perché il numero di particelle che passano dal liquido al vapore cresce.
Finché la pressione di vapore rimane inferiore alla pressione esterna, che generalmente coincide con la pressione atmosferica, si forma soltanto del vapore al di sopra della superficie del liquido. Quando però la pressione di vapore eguaglia la pressione esterna, il liquido inizia a bollire. In altre parole, si passa da un processo di vaporizzazione a un processo di ebollizione, per cui tutto il liquido (e non soltanto la sua superficie) inizia a passare allo stato gassoso.
Ciò significa che la temperatura di ebollizione di una sostanza non è altro che la temperatura a cui la sua pressione di vapore eguaglia la pressione esterna.
Possiamo capire bene questa cosa facendo un esempio con l’acqua.
Il motivo per cui l’acqua bolle a 100° è che a questa temperatura la sua pressione di vapore eguaglia quella esterna. Ed è sempre per questo motivo che in montagna l’acqua impiega meno tempo a bollire, perché lì la pressione atmosferica è più bassa che in pianura (e quindi la pressione di vapore impiega meno tempo a raggiungere il suo stesso valore).
Ecco spiegato perché l’acqua, così come qualsiasi altra sostanza, ha una temperatura di ebollizione precisa, che però cambia al variare della pressione esterna (generalmente la pressione usata come riferimento equivale a 1 atm).
I liquidi che evaporano facilmente sono detti volatili (la volatilità è la tendenza di un liquido ad evaporare).
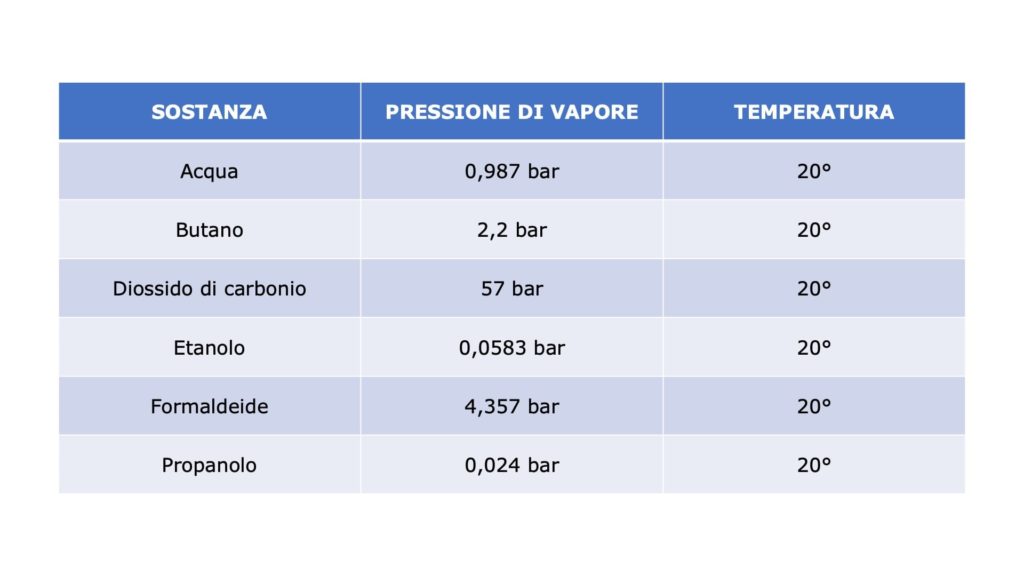
Attenzione
Il vapore in equilibrio con il proprio liquido si chiama tecnicamente vapore saturo (potremmo infatti avere anche un vapore in equilibrio con il proprio solido, se si verificasse un processo di sublimazione).
Pertanto, bisognerebbe parlare in teoria di “pressione di vapore saturo”, ma ormai tutti i manuali scolastici usano per semplicità l’espressione pressione di vapore.
