Tipi di reazioni chimiche
Le reazioni chimiche possono essere di quattro tipi:
- reazioni di sintesi
- reazioni di decomposizione
- reazioni di scambio semplice
- reazioni di doppio scambio
Reazioni di sintesi
In una reazione di sintesi due o più reagenti si combinano e formano un unico prodotto:
2Mg + O2 → 2MgO
Qui ad esempio il magnesio si combina con l’ossigeno e forma l’ossido di magnesio.
In queste reazioni i reagenti possono essere sia elementi sia composti.
Reazioni di decomposizione
In una reazione di decomposizione un unico reagente si scinde in due o più prodotti:
CaCO3 → CaO + CO2
Qui ad esempio il carbonato di calcio si scinde nel monossido di calcio e nel diossido di carbonio.
Di solito le reazioni di decomposizione si verificano quando il reagente viene scaldato (in questo caso sulla freccia dell’equazione viene aggiunto il simbolo Δ, cioè delta, che indica che è stato somministrato calore).
In queste reazioni il reagente è sempre un composto.
Reazioni di scambio semplice
In una reazione di scambio semplice un elemento reagisce con un composto e si scambia con uno degli elementi presenti nel composto:
Zn + CuSO4 → ZnSO4 + Cu
Qui ad esempio lo zinco reagisce con il solfato di rame e forma rame e solfato di zinco. In pratica, lo zinco prende il posto del rame nel composto.
L’elemento libero è sempre un metallo e si scambia o con un altro metallo o con l’idrogeno. Perché questo scambio avvenga, il metallo libero deve essere più reattivo del metallo o dell’idrogeno presente nel composto.
La scala di reattività dei metalli è la seguente:
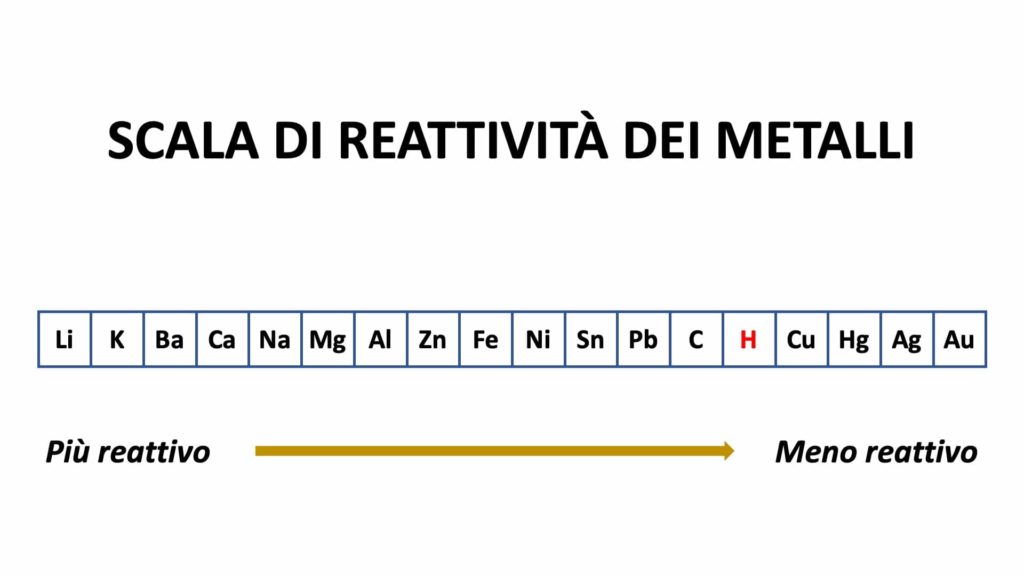
Ciò significa ad esempio che lo zinco può prendere il posto del rame, ma il rame non può prendere il posto dello zinco, dato che lo zinco è più reattivo di esso.
Reazioni di doppio scambio
In una reazione di doppio scambio due composti reagiscono tra loro e si scambiano a vicenda uno dei propri costituenti:
NaOH + HCl → NaCl + H2O
Qui ad esempio l’idrossido di sodio e l’acido cloridrico si combinano e formano il cloruro di sodio e l’acqua. Come possiamo notare, OH e Cl prendono l’uno il posto dell’altro nel passaggio dai reagenti ai prodotti.
Nelle reazioni di doppio scambio si forma sempre un gas, un precipitato (cioè un composto insolubile) o acqua.
Tabella riassuntiva dei tipi di reazioni chimiche
Ecco una tabella che riassume i tipi di reazioni chimiche:
| Tipo di reazione | Equazione generale | Esempio |
| Sintesi | A + B → AB | 2Mg + O2 → 2MgO |
| Decomposizione | AB → A + B | CaCO3 → CaO + CO2 |
| Scambio semplice | A + BC → AC + B | Zn + CuSO4 → ZnSO4 + Cu |
| Doppio scambio | AB + CD → AD + CB | NaOH + HCl → NaCl + H2O |
Quando si verifica una qualsiasi reazione chimica, la trasformazione dei reagenti in prodotti può inoltre avvenire con o senza trasferimento di elettroni. Le reazioni in cui si verifica un trasferimento di elettroni sono chiamate reazioni redox.
